相關法規
|
《醫療器械監督管理條例》
|
國務院令第680號
|
|
《醫療器械注冊管理方法》
|
國家食品藥品監督管理總局第4號
|
|
《體外診斷試劑注冊管理方法》
|
國家食品藥品監督管理總局第5號
|
|
《醫療器械說明書和標簽管理規定》
|
國家食品藥品監督管理總局第6號
|
|
《醫療器械生產監督管理方法》
|
國家食品藥品監督管理總局第7號
|
|
《醫療器械經營監督管理方法》
|
國家食品藥品監督管理總局第8號
|
|
《醫療器械分類規則》
|
國家食品藥品監督管理總局第15號
|
|
《醫療器械臨床試驗質量管理規范》
|
國家食品藥品監督管理總局第25號
|
|
關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告
|
國家食品藥品監督管理總局公告2014年第43號
|
|
關于公布體外診斷試劑注冊申報資料要求和批準證明文件格式的公告
|
國家食品藥品監督管理總局公告2014年第44號
|
|
《醫療器械產品技術要求編寫指導原則》
|
國家食品藥品監督管理總局通告2014年第9號
|
|
略......
|
|
NMPA認證登記注冊程序:
1.編寫產品標準。
2.與NMPA檢測中心協調并獲得檢測報告
3.如有需要須進行臨床試驗。
4.向NMPA提交申請。
5.NMPA技術文件審查。
6.獲得NMPA注冊。
醫療NMPA認證需提交資料:
(一)境內醫療器械注冊申請表;
(二)醫療器械生產企業資格證明:營業執照副本;
(三)適用的產品標準及說明:
采用國家標準、行業標準作為產品的適用標準的,應當提交所采納的國家標準、行業標準的文本;注冊產品標準應當由生產企業簽章。
生產企業應當提供所申請產品符合國家標準、行業標準的聲明,生產企業承擔產品上市后的質量責任的聲明以及有關產品型號、規格劃分的說明。
這里的“簽章”是指:企業蓋章,或者其法定代表人、負責人簽名加企業蓋章(以下涉及境內醫療器械的,含義相同);
(四)產品全性能檢測報告;
(五)企業生產產品的現有資源條件及質量管理能力(含檢測手段)的說明;
(六)醫療器械說明書;
(七)所提交材料真實性的自我保證聲明:
應當包括所提交材料的清單、生產企業承擔法律責任的承諾。
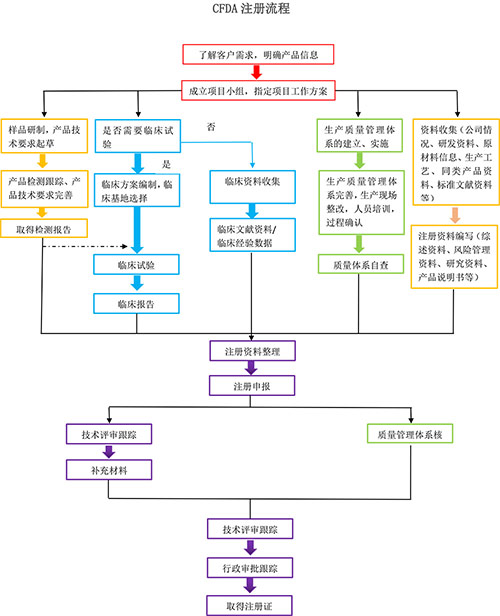
企業準備的注冊資料中,主要分為四個方面:產品檢測相關、臨床相關、體系相關、其他技術資料。在臨床、體系及其他技術資料方面,很多企業的注冊人員都能一一解決,而產品檢測往往是企業注冊過程中一大難題。基于此情況,并結合目前國內注冊檢驗的發展趨勢,
華通威提供如下服務:
1.樣品研制時華通威提供研發介入服務。
在產品設計開發初期,把標準及測試要求(如安規結構的要求、EMC的要求、元器件選材的要求),導入到產品研制中,避免研制的樣機出現不符合標準或測試要求的情況,導致重新改板或開模具。同時樣品研制后,正式測試前,提供預檢及再整改服務。
2.產品技術要求核對與驗證服務。
對于產品技術要求是否合理、齊全進行確認。對產品是否能達到技術要求中的指標進行驗證,并不斷完善
3.產品注冊檢驗或發補出具檢測報告服務
根據注冊要求及審批中心意見,進行國內注冊檢驗并出具報告直接用于注冊,包括但不限于電氣安全、電磁兼容、生物相容、環境測試、國/行標檢測等。(目前部分省市已開始接受第三方檢測報告,華通威已幫助多家企業出具二類注冊用報告并通過審批中心審核)






