
近期,由省外遷入廣東省注冊的4個注冊證獲批上市,成為首批按照《關(guān)于已上市第二類醫(yī)療器械遷入我省注冊申報指引(試行)》獲批的產(chǎn)品,省藥品監(jiān)管局重點綜合改革項目“優(yōu)化第二類醫(yī)療器械注冊審評審批”中省外已上市產(chǎn)品遷入我省注冊辦理新模式順利落地實施。
依據(jù)《醫(yī)療器械監(jiān)督管理條例》,第二類醫(yī)療器械由省級藥品監(jiān)管部門審批,企業(yè)跨省遷移一般按新產(chǎn)品在遷入地申請首次注冊,辦理周期較長。省藥品監(jiān)管局瞄準行業(yè)痛點,大力開展綜合改革,在為企業(yè)減負、優(yōu)化流程上下功夫,“三個明確”探索準入新模式。
一是明確主體責任。
跨省兼并、重組或?qū)偻患瘓F的省內(nèi)企業(yè),可將已獲省外第二類醫(yī)療器械注冊證產(chǎn)品遷入我省注冊,企業(yè)需開展前后產(chǎn)品差異評價,確保產(chǎn)品不發(fā)生實質(zhì)性變化。
二是明確程序標準。
按照標準不降低、程序不減少的原則,依據(jù)最新法規(guī)、文件要求開展申報資料、技術(shù)審評、注冊核查、生產(chǎn)許可審查,重點評估與產(chǎn)品質(zhì)量相關(guān)的風(fēng)險,確保產(chǎn)品質(zhì)量安全。
三是明確提速增效。
通過事前充分溝通交流、無紙化提交申報資料、提前開展注冊核查、優(yōu)化技術(shù)審評流程等方式,僅用5個工作日完成技術(shù)審評,比法定時間提速90%以上。
隨著我省醫(yī)療器械注冊工作進一步優(yōu)化和完善,審評審批效率顯著提升,跨省遷入新模式也得到了業(yè)界的積極響應(yīng)。目前已有30家企業(yè)的60多個產(chǎn)品正在對接遷移準備工作,有10多個產(chǎn)品即將進入注冊申報階段。接下來,省藥品監(jiān)管局將繼續(xù)暢通溝通交流渠道,強化事前指導(dǎo)服務(wù),積極探索境外企業(yè)通過其獨資、合資或者授權(quán)的我省企業(yè),將進口醫(yī)療器械落戶我省生產(chǎn)的辦理模式。
關(guān)鍵信息解讀——
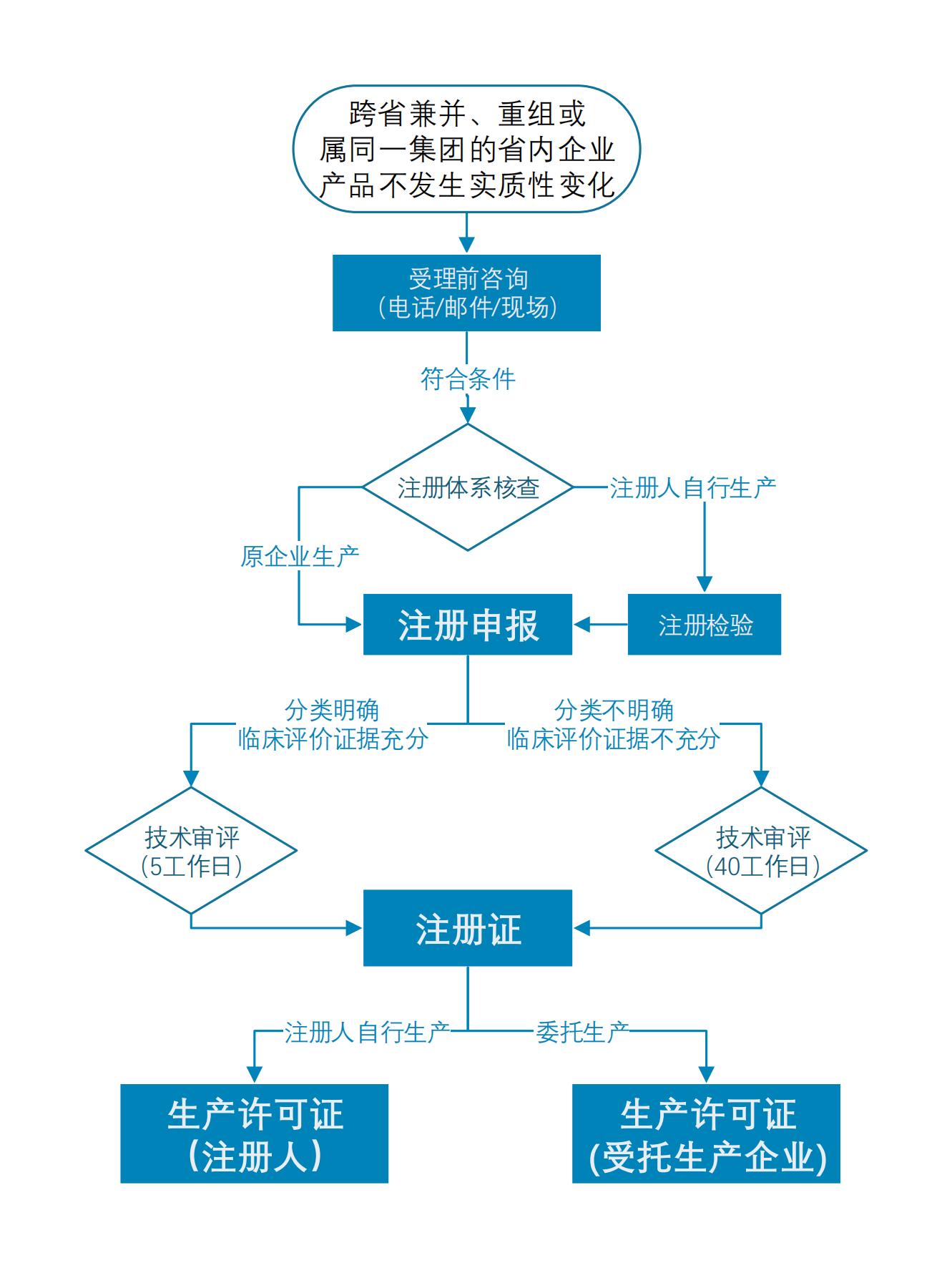
已上市第二類醫(yī)療器械遷入我省注冊申報指引如下
1.申報資料
醫(yī)療器械/ 體外診斷試劑產(chǎn)品的綜述資料、非臨床資料(不含注冊檢驗報告)、臨床評價資料,可提交已獲證醫(yī)療器械/體外診斷試劑的原注冊申報資料。
對擬遷入注冊的產(chǎn)品,繼續(xù)在原生產(chǎn)企業(yè)生產(chǎn)的,且生產(chǎn)條件(包括生產(chǎn)地址、生產(chǎn)要素 等)不發(fā)生變化的,注冊檢驗報告可提交原獲證時提交的報告。
2.技術(shù)審評
對產(chǎn)品分類明確、臨床評價證據(jù)充分的,技術(shù)審評時可僅對產(chǎn)品檢驗報告采納強制性標準的完整性、試劑類產(chǎn)品適用的國家標準品檢測情況進行審查,技術(shù)審評時限不超過5個工作日。
對產(chǎn)品分類不明確或臨床評價證據(jù)不充分的,應(yīng)按照正常程序開展技術(shù)審評。
3.注冊核查
注冊申請人應(yīng)當確保生產(chǎn)包含產(chǎn)品的主要生產(chǎn)工藝,并承諾主要原材料和生產(chǎn)工藝不發(fā)生改 變,提供產(chǎn)品生產(chǎn)質(zhì)量管理體系符合《醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范》及附錄的自查報告。
4.生產(chǎn)許可
注冊人自行生產(chǎn)的,應(yīng)按照《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》要求向省局申請辦理醫(yī)療器械生產(chǎn)許可。注冊人委托生產(chǎn)的,受托生產(chǎn)企業(yè)按照《醫(yī)療器械生產(chǎn)監(jiān)督管理辦法》有關(guān)要求向其所在地省級藥品監(jiān)管部門申請辦理醫(yī)療器械生產(chǎn)許可有關(guān)手續(xù)。

中檢華通威注冊服務(wù)指引
轉(zhuǎn)載注明:http://www.rkdu.cn/








