2023年1月6日,新年伊始,歐盟委員會正式通過了MDR過渡期延長法案,發布了《Brussels, 6.1.2023 2023/0005 (COD), amending Regulations (EU) 2017/745 and (EU) 2017/746 as regards the transitional provisions for certain medical devices and in vitro diagnostic medical devices》,該提案的通過給予了制造商更多時間來認證醫療器械,以降低醫療資源短缺的風險。
一、法規背景
歐盟醫療器械(EU)2017/745(MDR)和體外診斷(EU)2017/746(IVDR)新法規分別于2021年5月26日和2022年5月26日正式生效。新法規為醫療器械和體外診斷建立了更為嚴格的監管體系。受限于產品種類繁多、公告機構容量不足,制造商準備不足和新冠肺炎疫情的影響等,很多MDD下的產品還沒有成功切換為MDR。如下圖所示,公告機構頒發的MDR證書數量遠小于制造商的申請數量,預計到 2024年5月頒發的MDR 證書數量可能僅7000 份左右,而目前市場上共計17095個證書將在 2024 年5月份前到期。因此,實行過渡期延長法案迫在眉睫。
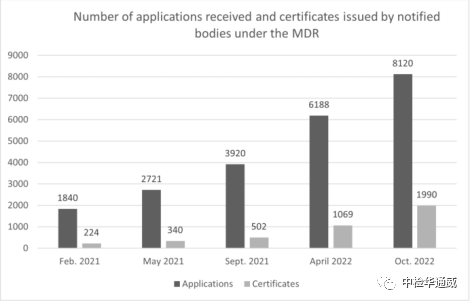
MDR實施后收到的申請數和被通報機構出具的證書數(截至2022年10月)
二、過渡期延長法案
|
器械分類
|
修正法案要求
|
|
Ⅲ 類器械
IIb 類植入器械 (除縫合線釘 (吻合器) 、牙科填充物牙套、牙冠、螺釘、楔子、板、線、針、夾子和連接器)
|
延長至2027年12月31日
|
|
除上述外的所有 Ilb類器械 lla器械以及 I類滅菌或帶測量功能的器械
|
延長至2028年12月31日
|
|
在MDD時期不需要公告機構審核,但在MDR時期需要公告機構審核的器械
|
延長至2028年12月31日
|
三、過渡期延長的適用條件
? 醫療器械必須繼續遵守指令90/385/EEC或指令93/42/EEC;
? 醫療器械的設計和預期用途沒有發生重大變更;
? 醫療器械不會對患者、用戶或其他人的健康或安全,或對保護公眾健康的其他方面造成不可接受的風險;
? 2024年5月26日之前,制造商必須根據MDR第10(9)條建立質量管理體系(QMS);
? 2024年5月26日之前,制造商或其授權代表需根據MDR附件VII第4.3節提出正式申請,就指令證書或符合性聲明涵蓋的“遺留設備”,或就MDR下用于替代該設備的設備,進行符合性評估。并且,制造商需和公告機構根據本法規附件VII第4.3節簽署書面協議,不遲于2024年9月26日。
原文鏈接:https://health.ec.europa.eu/system/files/2023-01/mdr_proposal.pdf
中檢華通醫療器械質量服務
中檢華通威是中國中檢下屬專業醫療器械檢驗機構,是集醫療器械產品測試、認證、技術法規咨詢、臨床驗證為一體的“一站式”醫療器械產品質量服務平臺。也是唯一一家專門從事檢驗認證的中央企業。
一、產品檢驗/檢測
電氣安全、電磁兼容、產品性能、理化、生物相容性檢測、生物安全評價、清洗消毒驗證、內毒素、產品有效期驗證、臨床前功能評價、SAR、無線共存等測試能力。
二、國內注冊/全球市場準入
中國NMPA(CFDA)
美國FDA
歐盟CE
澳大利亞TGA
加拿大CMDCAS
英國UKCA
巴西ANVISA (INMETRO,ANATEL )
三、咨詢服務
前期產品研發法規輔導
產品技術要求評審服務
臨床評價
輔廠建設
質量管理體系建設
轉載注明:http://www.rkdu.cn/






