歐盟體外診斷醫療器械新法規(IVDR)于2017年5月25日正式發布并生效,并于2022年5月26日起開始實施,自實施日起,歐盟IVDR將取代原來的歐盟體外診斷設備指令IVDD。
問新法規IVDR開始實施會帶來什么變化呢?
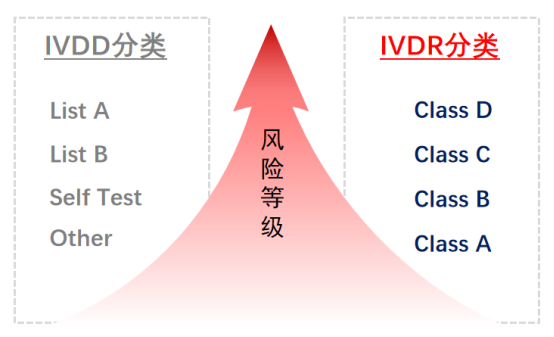
1、產品風險等級分類變化:新的IVDR法規產品風險等級將IVD產品分為四大類,風險從低至高排列:ClassA,ClassB,ClassC,ClassD.
2、產品注冊要求變化:新分類中ClassB,C,D都需要歐盟公告機構(Notify Body)發證后產品才能進入歐盟市場。
這將意味著原來IVDD監管體系下需要NB機構發證的IVD產品從原來占據市場份額的20%劇增至80%以上。即絕大部分產品將要從原先“自我聲明”形式變成需要一個實質性的注冊過程(NB機構參與發證)。
問依據IVDD指令獲得歐盟市場準入的產品該何去何從?
2021年10月14日,因公告機構負荷不足,貿然執行IVDR會引發大面積的體外診斷產品斷供,因此歐盟發布了IVDR延期提案。該提案修正了(EU)2017/746法規第110條(過渡性條款)對IVDD到IVD過渡期的規定,具體的過渡期如下:
【注】雖然過渡期法案發布后,IVD產品有了3~5年的過渡緩沖期,到目前為止歐盟官網發布的具備IVDR發證資質的公告機構(NB)僅僅7家,考慮到IVDR較長的認證周期、稀缺的公告機構資源,制造商必須結合自身產品的情況至少提前兩年以上進行申請和排隊,這么一來,許多產品實際上時間并不充裕,現在就需要布局認證計劃啦,中檢華通威將協助您的產品順利過渡并獲得CE認證!
中 檢 華 通 威 服 務
01\產品檢驗/檢測
安全、EMC、理化性能檢測、生物相容性檢測、產品有效期驗證、生物安全評價、清洗消毒驗證、內毒素、臨床前功能評價、SRRC、無線共存等
02\國內注冊/全球市場準入
中國NMPA(CFDA)
美國FDA
歐盟CE
巴西ANVISA (INMETRO,ANATEL )
澳大利亞TGA
加拿大CMDCAS
英國UKCA
03\咨詢服務
前期產品研發法規輔導
產品技術要求評審服務
臨床評價
輔廠建設
質量管理體系建設
轉載注明:http://www.rkdu.cn/






